Новости Мира
Ваш надежный партнер!

Опубликовано: 22.10.2018
Среднюю пробу воды из источников водоснабжения отбирают следующим образом. Пробы воды берут в стеклянные бутылки, тщательно вымытые, ополоснутые дистиллированной водой и плотно закрытые пробками. При взятии пробы бутылки несколько раз ополаскивают той водой, которую берут для исследования, затем заполняют ею и закупоривают.
При взятии проб из открытых водоемов привязывают к шесту небольшую бутылку с узким горлышком и погружают ее в воду для наполнения. Содержимое нескольких таких флаконов, взятое из разных мест и с разных глубин, составляет среднюю пробу.
При взятии пробы из водопровода надо в течение 10 мин спустить воду, чтобы в пробу не попала вода, застоявшаяся в трубах; затем, ополоснув бутылки, наполняют их исследуемой водой. Для проведения химического анализа необходимо не менее 3 л воды.
Анализ воды следует проводить сразу же после отбора пробы во избежание возможных изменений. Если почему-либо невозможно выполнить анализ сразу, воду надо хранить при температуре, близкой к 0° С, и записать продолжительность хранения, которая не должна превышать для незагрязненной воды 72 ч, для малозагрязненной - 48 ч. При передаче воды для анализа в лабораторию на склянку наклеивают этикетку с указанием места и даты отбора, метеорологических условий, температуры воды, цели исследования воды, подписи и должности лиц, отобравших пробу.
Исправленную воду отбирают после водоочистительной установки через кран после спуска воды в течение 2-3 мин.
Температура воды измеряется в момент отбора пробы.
Прозрачность. Ориентировочное определение прозрачности проводят в пробирке, в которую налито 10 мл исследуемой воды. Воду в зависимости от степени прозрачности условно подразделяют на прозрачную, слабоопалесцирующую, опалесцирующую, слегка мутную, мутную и сильно мутную.
Цветность. Определение цветности проводят в прозрачной воде. Если вода непрозрачна, ее фильтруют. Пробирку наполняют исследуемой водой почти доверху, ставят на белую бумагу и, глядя сверху, определяют цветность. Цветность воды характеризуют следующим образом: бесцветная, зеленоватая, желтая, бурая и т.п.
Запах. Запах определяют при 18-20° С органолептически. Исследуемую воду наливают в колбу емкостью 200-250 мл с широким горлом примерно на 2/3 ее объема. Накрывают колбу часовым стеклом, встряхивают вращательными движениями в закрытом состоянии, открывают, быстро втягивают носом воздух из колбы и отмечают запах: без запаха, сероводородный, болотный, гнилостный, плесневой и т.д. Интенсивность запаха оценивают по шкале: нет, очень слабый, слабый, заметный, отчетливый, очень сильный.
Вкус. Определение вкуса проводят при температуре 18-20° С. Набирают в рот примерно 15 мл воды и держат во рту несколько секунд; проглатывать воду не следует. Различают соленый, горький, сладкий и кислый вкус. Остальные вкусовые ощущения называют привкусами. Интенсивность вкуса оценивают по такой же шкале, что и запах. Явно недоброкачественную воду на вкус пробовать не следует.
В бюкс помещают фильтр и высушивают 2,5-3 ч в сушильном шкафу при температуре 105-110° С до постоянной массы. После взвешивания фильтр осторожно вынимают, вставляют в воронку и слегка увлажняют несколькими каплями дистиллированной воды.
Пробу исследуемой воды хорошо взбалтывают, быстро отбирают из нее мерным цилиндром 500-1000 мл и фильтруют через приготовленный фильтр, перенося при этом на фильтр все взвешенные в воде частицы. Затем цилиндр промывают 2-3 раза дистиллированной водой, также пропуская ее через фильтр (промывные воды отделяют, не смешивая с профильтрованной исследуемой водой). Осадок взвешенных частиц вместе с фильтром переносят в тот же бюкс, в котором высушивали фильтр, и высушивают при 105-110° С до постоянной массы. Содержание взвешенных веществ (ВВ) вычисляют по формуле
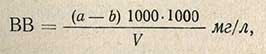
где а - масса бюкса с фильтром и взвешенными веществами, г; b - масса бюкса с фильтром (без взвешенных веществ), г; V - объем исследуемой воды, взятый для определения, мл.
Ниже излагаются определения плотного остатка, окисляемости, жесткости воды, которые проводят в фильтрованной воде. Качественные и количественные определения катионов и анионов в воде из-за недостатка места опущены. Их можно найти в учебниках по аналитической химии и в специальных руководствах по анализу воды, в том числе: М. А. Ананьевская, Л. Г. Щекатурина. Руководство по химическому анализу воды. Новочеркасский политехнический институт. Новочеркасск, 1960; А. А. Резников, Е. П. Муликовская, И. Ю. Соколов. Методы анализа природных вод. Госгеолтехиздат, 1963.
250 мл профильтрованной исследуемой воды (после определения взвешенных веществ) выпаривают на водяной бане в прокаленной и взвешенной платиновой или фарфоровой чашке, наполняя ее по мере испарения воды не более чем на половину объема. После испарения воды чашку с осадком высушивают (2,5-3 ч) в сушильном шкафу при 105-110° С до постоянной массы. Массу осадка в миллиграммах умножают на 4 (взято 250 мл воды) и находят содержание сухого остатка в мг в 1 л воды.
Окисляемостью воды называют способность веществ, содержащихся в воде, реагировать с окислителями. Величину окисляемости выражают числом миллиграммов кислорода, необходимым для окисления веществ, содержащихся в 1 л исследуемой воды. Окисляемость характеризует степень загрязненности воды органическими веществами. Наиболее распространенным методом определения окисляемости воды является перманганатный метод, основанный на окислении органических веществ перманганатом калия при нагревании.
В зависимости от содержания в воде хлориона определение проводят в кислой или щелочной среде: при содержании хлор-иона до 100 мг/л - в кислой среде, более 100 мг/л - в щелочной. При определении в кислой среде восстановление перманганата калия проходит по реакции
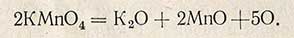
Избыток введенного перманганата калия титруют раствором щавелевой кислоты. Реакция протекает по уравнению
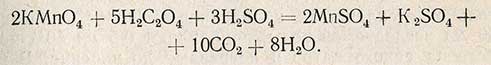
Значительное содержание хлор-иона оказывает влияние на реакцию окисления в кислой среде:
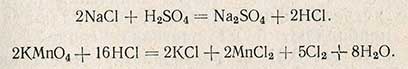
В этом случае окисление необходимо вести в щелочной среде; реакция протекает по уравнению
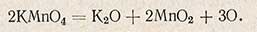
Избыток введенного перманганата калия в этом случае также оттитровывают щавелевой кислотой в кислой среде. Выпавшая двуокись марганца при этом восстанавливается щавелевой кислотой по уравнению
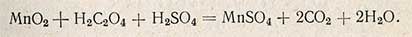
В коническую колбу емкостью 250 мл опускают несколько стеклянных капилляров, вносят пипеткой 100 мл исследуемой воды, прибавляют 5 мл разбавленной серной кислоты (1:3) и 10-15 мл 0,01 н. раствора перманганата калия; при этом должна появиться интенсивная розовая окраска. Колбу закрывают часовым стеклом, нагревают до кипения и кипятят точно 10 мин, наблюдая все время за окраской.
Если окраска жидкости во время кипячения сильно ослабевает, то прибавляют еще несколько миллилитров 0,01 н. раствора перманганата калия и снова кипятят. После кипячения колбу снимают с нагревательного прибора, вносят в нее 10 мл 0,01 н. раствора щавелевой кислоты и сразу титруют обесцвечивающийся горячий раствор 0,01 н. раствором перманганата калия, прибавляя его по каплям до появления слабо-розовой окраски, не исчезающей в течение 1 мин.
В коническую колбу емкостью 250 мл опускают несколько стеклянных капилляров, вносят пипеткой 100 мл исследуемой воды, прибавляют 0,5 мл 50%-ного раствора едкого натра и нагревают до кипения. В начале кипения прибавляют 10-15 мл 0,01 н. раствора перманганата калия и кипятят точно 10 мин, закрыв колбу часовым стеклом. После кипячения колбу снимают с нагревательного прибора, охлаждают до 50-60° С, прибавляют 5 мл раствора серной кислоты (1:3) и 10 мл 0,01 н. раствора щавелевой кислоты. Раствор после обесцвечивания титруют 0,01 н. раствором перманганата калия до появления слабо-розовой окраски, не исчезающей течение 1 мин.
Окисляемость воды рассчитывают по формуле
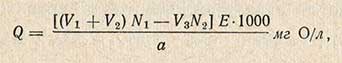
где V1 - объем раствора перманганата калия, прилитый в начале нагревания, мл; V2 - объем раствора перманганата калия, израсходованный на титрование избытка щавелевой кислоты, мл; N1 - нормальность раствора перманганата калия; V3 - объем прилитого раствора щавелевой кислоты, мл; N2 - нормальность раствора щавелевой кислоты; а - объем исследуемой воды, взятый для определения окисляемости, мл; Е - эквивалент кислорода, равный 8.
Различают жесткость воды общую, временную (устранимую), постоянную (неустранимую), карбонатную и некарбонатную. Общая жесткость воды обусловлена общим содержанием в ней ионов кальция и магния. Временной жесткостью называют жесткость, которая обусловлена присутствием в воде гидрокарбонатов кальция и магния; при кипячении гидрокарбонаты кальция и магния превращаются в карбонаты и выпадают в осадок. Постоянная жесткость обусловлена присутствием главным образом хлоридов и сульфатов кальция и магния. Общая жесткость равна сумме временной и постоянной жесткости. Карбонатная жесткость обусловлена наличием в воде гидрокарбонатов не только кальция и магния, но и натрия, калия, железа, алюминия, а также карбонатов этих же катионов. Карбонатную жесткость выражают в миллиграмм-эквивалентах гидрокарбонат- и карбонат-ионов (HCO3- + СО32-) в 1 л воды. Когда число миллиграмм-эквивалентов НСО3- и СО32- в воде больше суммы миллиграмм-эквивалентов кальция и магния, то карбонатную жесткость считают равной общей жесткости.
Жесткость воды наиболее часто определяют трилонометрическим методом - с помощью трилона Б. Трилон Б - это двунатриевая соль этилендиаминотетрауксусной кислоты, образующая прочные комплексы с ионами трех- и двухвалентных металлов, в частности с ионами кальция и магния. Схематически взаимодействие трилона Б с ионами кальция (или магния) может быть представлено уравнением
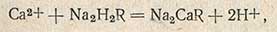
где R - радикал этилендиаминотетрауксусной кислоты.
Из приведенного уравнения видно, что при титровании трилоном Б ионы кальция выводятся из раствора и появляются ионы водорода. Для их связывания необходимо поддерживать pH 8-10, что достигается прибавлением аммиачного буферного раствора. Если в раствор, содержащий ионы кальция или магния, ввести индикатор, дающий цветные соединения с этими ионами, то при добавлении трилона Б к такому окрашенному раствору произойдет изменение окраски в эквивалентной точке. В качестве индикаторов используют: хромоген черный специальный ЕТ-00 (эриохром черный Т) и кислотный хром темно-синий. Цвета растворов этих индикаторов в щелочкой среде следующие:

При определении жесткости конденсатов и умягченной воды в качестве индикатора пользуются кислотным хромом темно-синим, так как хромоген черный ЕТ-00 обладает недостаточной чувствительностью. Используемые для данного определения индикаторы являются чувствительными реактивами на многие тяжелые металлы, вследствие чего присутствие последних мешает определению кальция и магния.
Для устранения искажающего влияния ионов меди и цинка следует перед определением жесткости перевести их в сульфиды добавлением 1 мл 2%-ного раствора сульфида натрия. Влияние марганца устраняют добавлением пяти капель 1%-ного раствора солянокислого гидроксиламина. Если содержание железа или алюминия во взятом для титрования количестве исследуемой воды превышает 1 мг, то исследуемой воды следует взять соответственно меньше и разбавить ее дистиллированной водой.
При определении жесткости воды трилонометрическим методом содержание ионов кальция и магния в объеме исследуемой воды не должно превышать 0,5 мг-экв. Поэтому рекомендуют следующие объемы проб исследуемой воды в зависимости от предполагаемой жесткости воды.

В коническую колбу емкостью 250 мл пипеткой отмеряют необходимое количество исследуемой воды в зависимости от предполагаемой жесткости воды. Затем, если нужно, добавляют дистиллированную воду до объема 50 мл, прибавляют 5 мл аммиачного буферного раствора, 10 капель индикатора и медленно титруют 0,01 н. раствором трнлона Б, все время энергично перемешивая содержимое колбы встряхиванием до изменения окраски. Свидетелем может служить перетитрованная проба, так как при прибавлении избытка раствора трилона Б окраска больше не изменяется.
Величину общей жесткости (Hобщ) рассчитывают по формуле
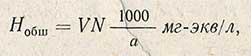
где V - объем раствора трилона Б, израсходованный на титрование, мл; N - нормальность раствора трилона Б; а - объем исследуемой воды, взятый для определения, мл.
В коническую колбу на 250 мл отмеряют пипеткой необходимое количество воды в зависимости от предполагаемой постоянной жесткости, отмечают уровень ее в колбе карандашом по стеклу, закрывают воронкой и кипятят в течение часа, подливая время от времени дистиллированную воду до карандашной метки. По окончании кипячения и охлаждении объем воды доводят до метки дистиллированной водой, фильтруют в сухую колбу через сухой фильтр, промывают его 2-3 раза дистиллированной водой. Промывные воды собирают в одну колбу с фильтратом и титруют 0,01 н. раствором трилона Б, как указано при определении общей жесткости. Величину постоянной жесткости рассчитывают по той же формуле, что и общую жесткость.
Определение карбонатной жесткости основано на свойстве гидрокарбонатов кальция и магния, а также гидрокарбонатов и карбонатов натрия, калия, железа и алюминия вступать в реакцию с кислотой:
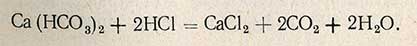
Определение карбонатной жесткости проводят титрованием 0,1 н. раствором соляной кислоты в присутствии метилоранжевого. В коническую колбу емкостью 250 мл, закрывающуюся резиновой пробкой, отмеряют пипеткой 100 мл исследуемой воды, прибавляют 2-3 капли метилоранжевого и титруют 0,1 н. раствором соляной кислоты до появления слабо-оранжевой окраски. Величину карбонатной жесткости Hк рассчитывают по формуле.
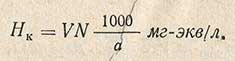
где V - объем 0,1 н. раствора соляной кислоты, израсходованный на титрование, мл; N - нормальность раствора соляной кислоты; а - объем исследуемой воды, взятый для определения карбонатной жесткости, мл.
Определение устранимой жесткости основано на определении карбонатной жесткости в сырой воде и в прокипяченной. При определении карбонатной жесткости в сырой воде в реакцию с соляной кислотой вступают гидрокарбонаты и карбонаты щелочных металлов (натрия, калия) и гидрокарбонаты щелочноземельных металлов (кальция и магния). При том же определении в прокипяченной воде в реакцию с соляной кислотой вступают только карбонаты щелочных металлов вследствие разрушения гидрокарбонатов и выделения в осадок карбонатов кальция и магния. Разность между этими двумя определениями дает величину устранимой жесткости.
Ход определения следующий. В коническую колбу отмеряют пипеткой 100 мл исследуемой воды, прибавляют две капли метилоранжевого и титруют 0,1 н. раствором соляной кислоты до перехода желтой окраски в оранжевую. Другую порцию воды в 100 мл также отмеряют пипеткой в коническую колбу. Колбу закрывают воронкой, отмечают уровень воды карандашом по стеклу и кипятят в течение часа, подливая время от времени дистиллированную воду до карандашной метки. После кипячения воду охлаждают, доводят объем ее до метки дистиллированной водой и фильтруют в сухую колбу через сухой фильтр. Фильтр промывают 2-3 раза дистиллированной водой. Промывные воды собирают вместе с фильтратом и титруют 0,1 н. раствором в присутствии метилоранжевого до изменения окраски.
Величину устранимой жесткости Hустр рассчитывают по формуле
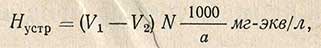
где V1 - объем 0,1 н. раствора соляной кислоты, израсходованный на титрование порции сырой исследуемой воды, мл; V2 - объем 0,1 н. раствора соляной кислоты, израсходованный на титрование порции прокипяченной исследуемой воды, мл; N - нормальность раствора соляной кислоты; а - объем исследуемой воды, взятый для определения, мл.



2013 © Все права защищены. www.osreg.ru . При копировании материала с сайта не забываем указывать источник в виде активной ссылки на сайт.